|
|||
動的で複雑な生命現象を理解するためには、生体内の種々のシステムを個別に制御可能な形で人工的に再構成し、微小な摂動を与えたときの応答と照合することでシステムの理解を深めるアプローチが有効である。そこで「はかる」「モデル」により得られた生命反応システムの動作データおよびその数理モデルを基に、大規模計算を用いた分子複合体・遺伝子ネットワーク・細胞ネットワークのデザインを行う。さらに、機能的な分子複合体・遺伝子ネットワーク・細胞ネットワークを制御可能な系として再構成・設計し、分子・細胞機能の動態計測・変調操作を可能とする。こうした生命システムの再構成・設計により、生命システムに特徴的な動作・設計原理の構成的な理解を目指す。具体的には、周期現象や老化などを含めた時間制御システム、細胞における極性の自律的発生などの発生過程に見られる細胞の空間制御システム、細胞の「状態」を定義する論理制御システム、などの構成的な理解を目指す。 |
|||
新しい生命科学の実現に向けて上述の目標を達成するために、各学問領域の先進的技術を組み合わせることで新規基盤技術の創出を必要不可欠である。まず、細胞機能の再構成・設計を通じて得られた動作・設計原理を実際の細胞内で検証するために、設計した多数の遺伝子またはタンパク質を組み合わせたネットワーク構造を細胞内で構築し、それらを評価する革新的技術基盤を創出する。そのために必須な技術として、①生命の基本構成部品である遺伝子やタンパク質を迅速かつ網羅的に提供するインフラ技術を整備する。加えて、②設計・合成された一連の遺伝子群を細胞内のゲノムに組み込む技術、③ゲノムが改変された細胞を高速かつ並列的に選別する技術、並びにそれらのゲノム改変細胞を一細胞レベルで包括的に機能評価するシステム、を確立する。これらの技術開発は、分子生物学や有機化学、最先端計測技術、ナノ製造技術など様々な異分野の技術を結集させることで初めて実現可能なものであり、細胞機能を支える分子複合体・遺伝子ネットワークのシステム的な理解をもたらすものである。なお、個体レベルにおける生命システムの理解を見据えて、これらの新規技術は哺乳類細胞、特に個体作製の基になるES細胞、に適用可能なフォーマットとしての確立を目指す。 |
|||
個体内での細胞ネットワークの動態を理解するためには、「細胞」ネットワークと「個体」機能との因果関係を同定・解析し、「個体」機能の制御・設計を目指す新しい生命科学分野を開拓することが必要不可欠である。そこで、生命機能の「情報」を司る遺伝子やタンパク質のネットワークから「細胞」機能の理解を目指したアプローチを拡張し、④複数個所のゲノム改変を経た細胞から大規模かつ短時間に個体を作製する技術を開発し、表現型解析を行うための高速かつ並列的な実験プラットフォームを確立する。「情報」から「個体」の機能を設計する、生命システムのデザインに向けた一連の方法論の開発に挑む |
|||
具体的な技術課題を以下に詳述する。 (1)新規DNA合成法の確立 生命機能を人工的にデザインし組み立てるためには、設計図となる一連の遺伝子群を迅速・低コスト・正確・網羅的に提供する革新的技術の創出が求められる。遺伝子の複製・転写に関与する酵素や三リン酸基質を化学的に機能改変する技術、単一分子レベルの高感度なイメージング技術、MEMSデバイスを用いた並列化技術を組み合わせることで、新規の遺伝子合成法の確立を目指す。 |
|||
| (2)細胞内ゲノム改変技術の開発 「モデル」により設計された分子やネットワーク構造を細胞内で実証するためには、内在性のゲノムを自在に目的の遺伝子へと書き換える技術が必須となる。そこで、細胞内のゲノムに結合する「認識ユニット」と、化学的に遺伝子を切断する「分解ユニット」をそれぞれ開発し、それらを連結することで人工制限酵素を開発する。この人工制限酵素を用いてゲノムの特異的切断とその修復機構を利用することにより、細胞内ゲノムの任意の部位に任意の変異を導入する技術を開発する。 (3)高速・並列的なゲノム改変細胞の樹立および一細胞機能評価システムの開発 将来的に個体機能を自在に改変・制御するために、哺乳類細胞、特にES細胞を対象としたゲノム改変細胞樹立のハイスループット化を実現する。細胞内のゲノムDNAの変異を検出する1分子感度蛍光イメージング技術を開発し、それらの光学技術と併用可能なマイクロ・拡張ナノ領域ガラス加工技術を組み合わせることで、変異型細胞樹立の高速化・並列化を実現する。 上記技術によって導入された人工の遺伝子・タンパク質ネットワークの機能を細胞レベルで正確に機能評価するためには、一細胞ごとのネットワーク動態を捉えることが必要である。例えば、高次機能のモデルケースとして細胞核の遺伝子転写システムを対象に、転写制御因子について、それらの発現ダイナミクスと転写活性への影響を一細胞レベルで測定するシステムを構築する。 (4)高速・並列化ゲノム改変マウス作製プラットフォームの確立 細胞ネットワークから個体機能を理解する個体の合成生物学を実現するためには、上述の技術により作製されたゲノム改変ES細胞からハイスループットに個体を作製し、かつそれら解析する必要がある。ゲノム改変ES細胞由来の"100%キメラマウス"を高効率に作製する手法を確立し、個体機能に関係する細胞種・細胞集団を高速かつ並列に同定できるための3次元蛍光顕微鏡の開発を目指す。 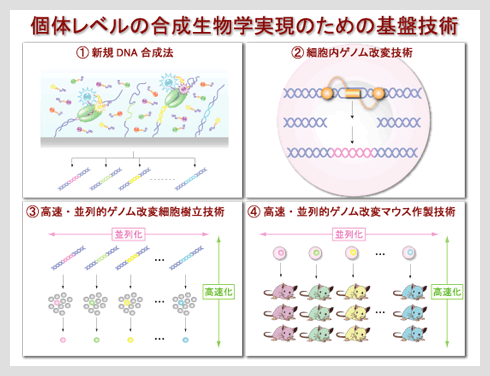 |
|||
| |このページの先頭へ↑| |

