TOP > ニュース・特集 > QBiCのこだわり > 量子ドットプローブを用いたマルチカラー1分子蛍光イメージング
【用語】
-
GPCR(G protein-coupled receptor; Gタンパク質共役受容体)
細胞が細胞外の刺激を認識する際に働く細胞膜上のタンパク質で三量体Gタンパク質と協同して細胞内にシグナルを伝達することからこの名前がついている。視覚や嗅覚、ホルモン伝達にも密接に関与している。GPCRの構造と機能の解明の功績には2012年にノーベル化学賞が授与された。
-
1分子蛍光イメージング
タンパク質などの生体分子1個を可視化し、それらが動く様子を時間を追って観察する技術。これにより分子モーターや酵素などの動作機構に関する数多くの知見が得られている。
-
全反射照明蛍光顕微鏡
レーザー光がガラスに全反射する際にガラスの裏側にしみ出す光(エバネッセント光)を励起光源とした顕微鏡。ガラス面から極狭い範囲(50-150nm)のみ照射することで背景に映り込む余分な光を大幅に減らすことができる。
-
光学限界
光学顕微鏡を用いて接近した2点を見て、それぞれの点として認識できる限界の距離。およそ波長の半分程度で、可視光であればおよそ200 nmである。
-
量子ドット
直径が10 nm以下の半導体微粒子で、光(可視—近赤外)を照射すると微粒子のサイズに応じた蛍光を発する。有機色素に比べ輝度が高く, 一波長励起によるマルチカラー蛍光、光安定性などに優れており、蛍光プローブとして応用が進んでいる。
-
cAR1(cyclic adenosine monophosphate receptor 1)
細胞性粘菌は餌が枯渇するとcyclic AMPを分泌し細胞同士が連携しながら集合する。この時cAR1は細胞膜上で細胞外cyclic AMPの受容体として働く。
QBiCのこだわり

2014年12月26日 ツイート
細胞の表面には薬物の受容体などが多数あり、細胞の外側の情報を内側に伝える働きを担っている。生きたままの細胞を使って、これらの分子の動きを解析することが、細胞の活動を理解する上で重要である。QBiCの共同研究チームは新たな量子ドット蛍光プローブを開発し、受容体分子をマルチカラーで標識した。これにより光学顕微鏡の解像度では分離できないほど近傍にある受容体分子を色で区別することができ、より詳細な1分子イメージングが可能になった。1分子イメージングで生きている細胞の分子の動きを捉える
人間をはじめ、すべての生命の活動は細胞が基本だ。細胞は、生命の活動に必要なエネルギーを作り出し、細胞内外で物質のやり取りを行い、生命を支える諸機能を実現している。このような細胞の活動において重要な役割を担っているのがタンパク質だ。細胞内や細胞膜には、1万種類を超えるタンパク質が存在し、それぞれの役割を担い、協調することで細胞の機能を実現している。また細胞膜表面に存在するGPCRタンパク質は多くの疾病に関与しており、現在用いられている薬の約半数がこれらGPCR膜タンパク質ファミリーをターゲットにしている。
GPCRなどの膜タンパク質に関する研究手法としては、細胞からタンパク質を抽出するなど、生化学や分子生物学的なアプローチがほとんどだったが、最近では蛍光イメージング法により、生きた細胞での膜タンパク質の振る舞いを研究できるようになった。この方法は1分子蛍光イメージングと呼ばれ、全反射照明蛍光顕微鏡などをもちいて膜タンパク質を1分子レベルで観察する。この手法により膜タンパク質が細胞膜上でどのように動いているかを時間を追って観察することができ、膜タンパク質がホルモンや薬物と結合する様子を観測することができる。
しかし、蛍光による1分子イメージングによってもタンパク質の振る舞いを詳細に観察するには限界がある。可視光を用いる場合、光学顕微鏡の分解能の限界は光の波長の半分程度(200 nm)であり、その中にタンパク質がいくつ存在していても1つ1つを区別することはできない。タンパク質の大きさは5 – 20 nm程度なので、分解能の範囲内には数多くのタンパク質が存在する。このため、これまでの1分子イメージングでは膜タンパク質の1割から2割程度しか観察できていなかった。
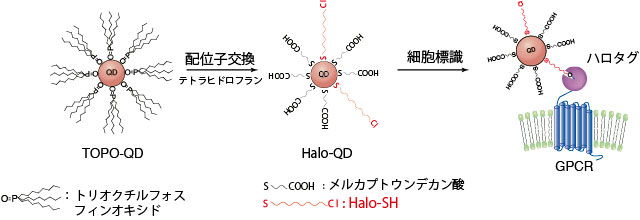
図1 量子ドットプローブ(Halo-QD)の合成とGPCRタンパク質の標識。QDの表面にハロタグ結合性リガンド(Halo-SH)を導入する。Halo-SHを介して細胞表面のハロタグ融合GPCRタンパク質を標識する。
マルチカラー1分子イメージング法の開発
QBiCナノバイオプローブ研究チームと細胞シグナル動態研究グループの共同研究グループは光学限界内に存在するGPCRタンパク質1つ1つを区別して、その振る舞いをより詳細に観察可能にするため、マルチカラーでの1分子イメージング法を開発した[1]。そのための蛍光プローブとして、半導体の微粒子である量子ドットを用いた。量子ドットは粒子サイズによって発光の色を変えることができ、発光する光の強さも有機色素に比べ10倍以上強く、退色しづらいという特徴を持つ。
高輝度で多色での発光特性を有するサイズの小さい(6 nm以下)量子ドットを合成する方法が確立され、これによりこれまで困難であった細胞膜タンパク質のマルチカラーでの1分子イメージングが簡便にできるようになった。
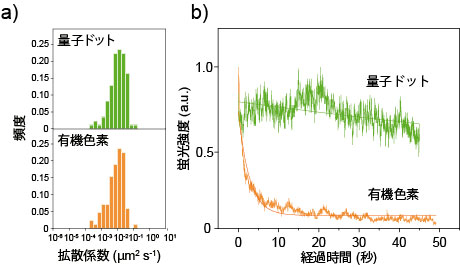
図2 a) 量子ドットプローブと有機色素プローブ(テトラメチルローダミン)を標識したcAR1タンパク質の細胞膜上での拡散定数の比較。両者で差は見られない。 b) ハロリガンド結合量子ドットプローブと有機色素プローブでの蛍光強度の時間変化。約1分間の測定で量子ドットの退色はほとんどなかった。
量子ドットプローブは、GPCR膜タンパクを標識するためのリガンド(ハロタグリガンド: Halo-SH)を量子ドットに結合させることにより作製した(図1)。この量子ドットプローブを用いて細胞性粘菌(Dictyostelium discoideum)のGPCR膜タンパク質の一種cAR1を蛍光標識した。このプローブは粒径が非常に小さいため、標識したGPCRタンパク質の振る舞いを阻害しない。また、有機蛍光プローブ(テトラメチルオーダミン)に比べ、輝度が非常に高く退色しないため長時間での1分子観察が可能だ(図2)。発光波長が緑・赤・近赤外と異なる3種類の量子ドットプローブを用いることによりcAR1タンパク質のマルチカラーでの1分子蛍光イメージングを実現した(図3)。マルチカラーイメージングでは光学限界内に存在する蛋白質を異なる発光色で区別できるため、1色での1分子蛍光イメージングに比べて約3倍もの多くの数のcAR1タンパク質を観測できた 。マルチカラーによる1分子イメージング法により光学限界内に存在するタンパク質を蛍光で区別して検出できることが明らかになった。
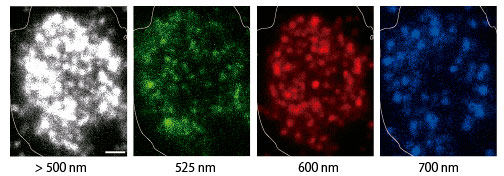
図3 細胞性粘菌のcAR1タンパク質の1色(白:>500 nmロングパス)およびマルチカラー量子ドットプローブ(緑:525 nm蛍光、赤:600 nm蛍光、青:700 nm蛍光)での1分子蛍光イメージング。スケールバー:1μm。
これらの利点に加え、汎用性や簡便性も今回開発したプローブの特徴だと筆頭著者のQBiCナノバイオプローブ研究チームの小松崎章仁氏は語る。「ハロタグ融合タンパク質を発現させた細胞を使う研究なら、このプローブがそのまま応用できます。また従来の1分子イメージング用の顕微鏡で計測できるので、多くの研究者に使ってもらえる技術になると期待しています」。
生命現象を支えるタンパク質の働きを顕微鏡で観察しようとするとき、光学限界の問題は避けて通れない。通常の方法では、200nm以内の現象を観察することができないため 2014年にノーベル化学賞を受賞した超解像顕微鏡技術など様々なアプローチがなされている。小松崎氏らの研究により、マルチカラー1分子蛍光イメージングが200nm以内にあるタンパク質のダイナミクスを研究するために有効であることが示された。
小松崎氏は「今後はこの技術を用いることによって膜タンパク質のダイナミクスを詳細に明らかにすることができ、GPCRタンパク質が関与した免疫・炎症反応などの作用機構や薬物の作用機序の解明に貢献することができるでしょう。」と語る。
- A. Komatsuzaki, T. Ohyanagi, Y. Tsukasaki, Y. Miyanaga, M. Ueda and T Jin, “Compact Halo-Ligand Conjugated Quantum Dots for Multicolored Single-Molecule Imaging of Overcrowding GPCR Proteins on Cell Membranes" Small, 2014. DOI:10.1002/smll.201402508


