Research
光学顕微鏡をはじめとする光計測技術は、古くから医学・生命科学の発展に大きく貢献してきました。シーケンサやリアルタイム定量 PCR、ELISA等の計
測技術を基盤とした分析ツールは、現代の医学・生命科学にとって必須となっています。しかし、近年になり、生命現象は複雑すぎて、従来の分解分析型の計測は限界があることが認められており、新コンセプトの計測技術の開発が待たれています。私たちの大きな挑戦は、生命科学研究において、これまでに無かった新しい概念の光の使い方を提案することです。私たちの開発は、一点突破型、すなわち、機能向上を目指した開発とは一線を画します。私たちは、これまで計測不可能であったパラメータを取得する、あるいは、物質表面から発せられた散乱光から内部情報を推定する、など、ゼロからイチを生み出す技術の開発を目指しています。そのために、光学のみならず、蛍光タンパク質や生体材料、マイクロ・ナノ流路、機械工作部品や制御ソフトウェアなど様々な要素技術から包括的(comprehensive)
に開発をしています。

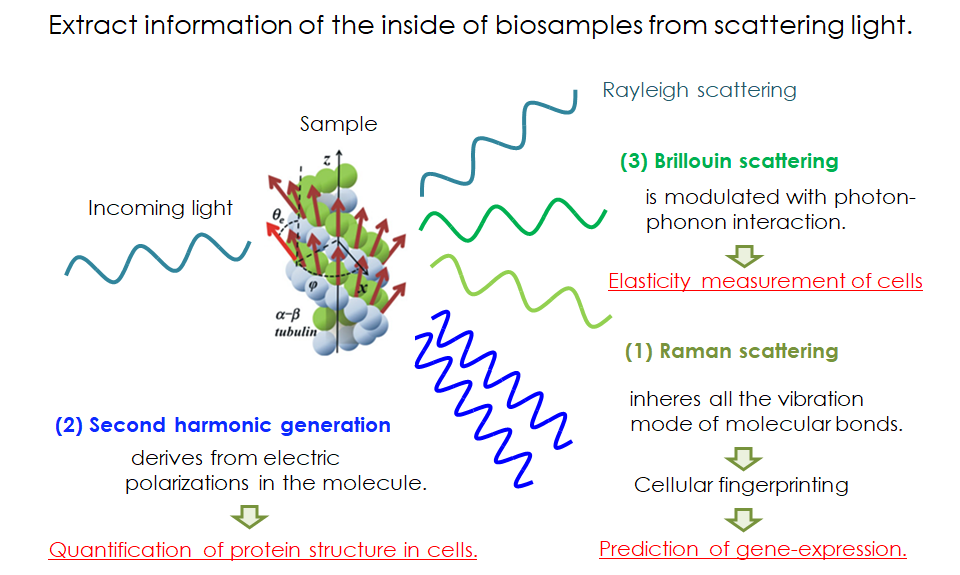
特に私たちが最近興味を持って開発を進めているのが、「散乱光」を用いた計測です。光は、物質を透過あるいは反射する際に内部状態 (構成分子や電子偏向状態)に修飾を受けてから散乱されます。つまり、散乱光は物質内部の情報を持っている、と言うことです。たとえば、ブリルアン散乱は物質内の弾性を、ラマン散乱は分子振動を、光第二高調波は電子的な偏りに関する情報を持っています。散乱光からこれらの情報を巧妙に取り出すことで、生物学研究における重要な情報を取得することができる、と私たちは考えています。具体的には、ラマン散乱光から細胞の遺伝子発現を推定する技術、光第二高調波からタンパク質の構造変化を検出する技術、ブリルアン散乱光から細胞弾性を計測する技術などを基盤技術として開発しています。さらに、これらの基盤技術を用いて実用的な生命科学ツールに展開していくまでが、私たちの研究室で行っている開発です。

一方で、私たちの研究は、光学ではありません。ここは、あくまでも生命科学の研究室です。研究室には多数の研究員が在籍しており、それぞれに生命科学の課題を持ち、その解決のための技術開発を行っております。研究室としては、それら別々の研究の結果から、生命現象に唯一無二の原理を発見しようと考えています。具体的には、生命現象における「個」と「集合」のフラクタル構造の原理です。生命の最小単位が、蛋白質であるとします。蛋白 質個々が、それぞれ相互作用し、複雑なネットワークを構成して、集団を形成し、ある機能を担います。その集団が、また、それぞれ相互作用を繰り返し、細胞として機能しています。そ して、細胞が集合し組織を、組織が集合し個体を、個体が集合し群を・・・、極小から極大まで、生命は「個」と「集合」の関係を持っているのです。私たち は「個」と「集合」を実際に計測し、実験的に「個と集合」の全貌を明らかにしたいと考えています。
以下に、少しだけですが、研究プロジェクトの例を記しておきます。興味のある方は、是非、目を通してみてください。
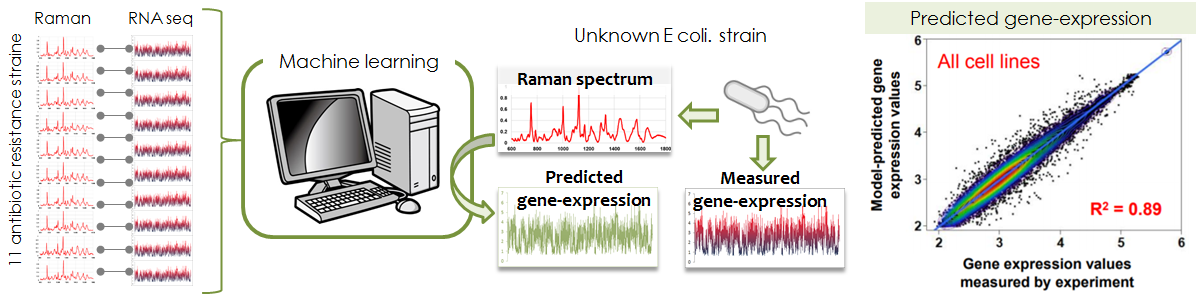
Raman cellular Fingerprinting
- 細胞から発せられるラマン散乱光から遺伝子発現を推定する
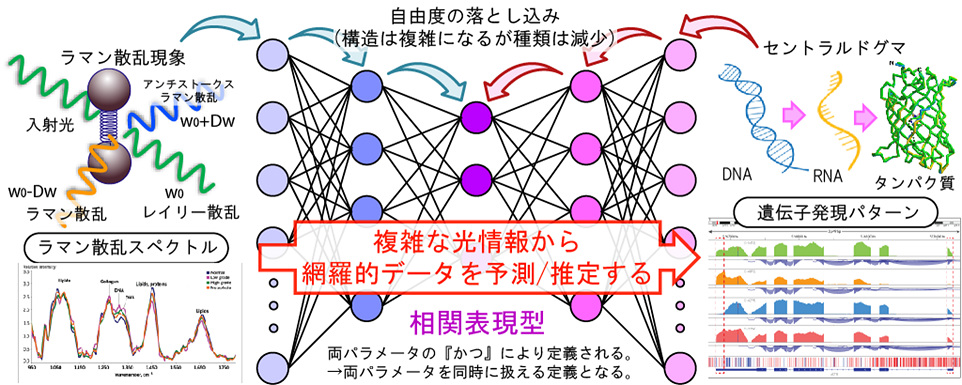
- 線形散乱光のひとつであるラマン散乱光のスペクトル形状は、物質内部の全ての分子振動モード(CC、SH、ベンゼン環等)により決定されます。つまり、ラマン散乱スペクトルを分解分析すれば、その信号元の分子構成が同定できます。しかしながら、細胞は大小種類を問わず様々な分子種から構成されているため、細胞から発せられるラマン散乱光のスペクトルは、分解分析することは出来ないほどに複雑になります。そのためラマン散乱光は、これまで生命科学において、あまり有効には使われてきませんでした。しかし、どれだけ複雑であっても、細胞内で遺伝子発現が変化すれば、構成分子の種類や比率も変化し、それに伴いラマン散乱スペクトルも変化します。つまり、計測されるラマン散乱スペクトルは「細胞の機能/状態」を介して遺伝子発現パターンと間接的であるが確実に相関関係があるはずです。大小種類を問わず因果関係が複雑に絡み合う生物の世界であるからこそ、複雑に修飾された散乱光(非侵襲で計測できる ラマン散乱光)から、多変量/単変量、質的変量/量的変量など問わず観察試料の内部状態(侵襲的にしか計測できない遺伝子発現)を予測/推定できる可能性があるのです。私たちは、細胞から発せられるラマン散乱光から遺伝子発現を予測する技術を確立し、この『散乱光から細胞内部を予測/推定する』コンセプトを実証することを目指しています。

- ラマン散乱光スペクトルから細胞の種類や状態を識別する
- これまでに私たちは、様々な哺乳類細胞株や胚性幹細胞(ES細胞)から分化させた様々な細胞について、ラマン散乱スペクトルを収集しました。機械学習手法を組み合わせることで、ラマン散乱スペクトルで種類や分化状態を非侵襲で識別できることを証明してきました。ラマン散乱スペクトルを「指紋」の様に用いていることから、細胞指紋技術と呼んでいます。私たちはこの原理を用いて、現在、人工多能性幹細胞(iPS細胞)の品質を管理する技術を開発しています。ラマン散乱スペクトル計測は、光を照射してその散乱光を計測するだけなので、細胞を死滅させることなく計測することが可 能であるため、医療応用に適していると考えられます。
- ラマン散乱光スペクトルから遺伝子発現を予測する
- 上述のコンセプトを実証するため、私たちは薬剤耐性大腸菌を題材として、ラマン散乱スペクトルから遺伝子発現の予測/推定に挑戦しました。10種類の薬剤耐性菌のラマン散乱スペクトルとRNAシーケンスデータのペアを収集し、ラマン散乱光スペクトルと遺伝子発現パターンとの相互関係をクラスリングしました。この実験は、これまでの分析・分解型研究では別々に扱われていた「代謝ネットワークと遺伝子発現ネットワーク」との言う層
の異なるネットワーク間の関連性を同時に扱っていると言えます。すなわち、従来のサイエンスとは異なり、多層を交えた定義が定量的に可能になると言うことです。たとえば、私たちの実験データでは、その相関をクラスタリングすると、薬剤耐性の種類ごとに集団が認められました。このクラスターから、薬剤により影響を受けた代謝ネットワークとそれに応じ発現量が変化した関連遺伝子群とを同時に同定できるのです。さらに、これら二つの異なるデータペアをつなぐための機械学習モデルを構築しました。この機械学習モデルにより80~90%の精度で、ラマン散乱スペクトルから薬剤耐性大腸菌の遺伝子発現
パターンを推測することに成功しました。

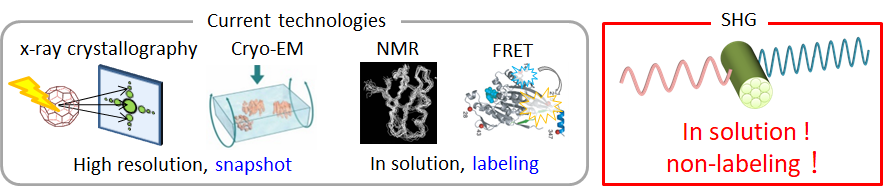
Structure analysis by utilizing Second harmonic Generation (SHG)
- 非線形散乱光からタンパク質構造の情報を取り出す
- 光を物質に照射した際に、その光の波長のちょうど半分の波長の光が発生し散乱光として検出されることがあります。この現象は、光第二高調波発生(Second
Harmonic Generation, SHG)と呼ばれます。より具体的には、SHGは2次の非線形光散乱現象のひとつであり、光が中心対称性のない結晶(非線形光学結晶)と相互作用した際に、その光の2倍の周波数の光が発生する現象を指します。結晶構造体や繊維構造体から選択的にSHG光が検出されることから、生命科学分野では、微小管繊維、筋原線維、コラーゲンなどの生体繊維を非染色で観察する方法として使われてきました。タンパク質結晶からも、タンパク質の電子配向すなわち構造情報に由来するSHGが発生します。すなわち、SHGを用いて、液中かつ非標識でタンパク質構造の変化を計測できる可能性があるのです。私たちは、SHGを計測原理とした新たなタンパク質構造解析手法の確立を目指しています。

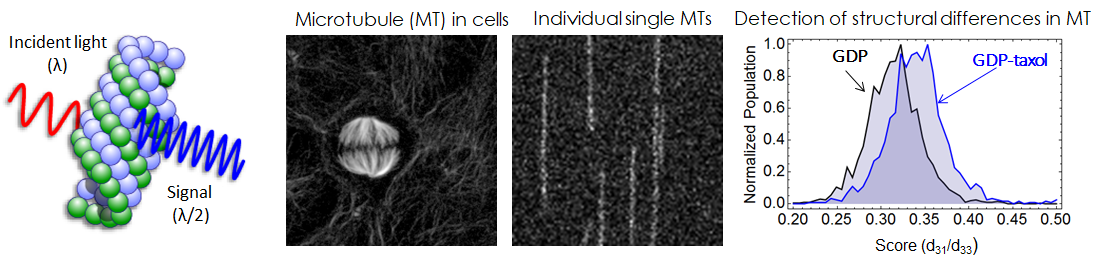
- タンパク質の構造相違をSHG計測により検出する
- 微小管は、細胞の中で「道路」の役割を果たしています。微小管の上をモータータンパク質と言うトラックが小胞などの荷物を運んでいるのです。近年、この微小管に、信号の「赤と青」に対応する構造があることが予想されていました。微小管を構成するタンパク質の構造の違いによって、モータータンパク質が走るか走らないか決まっている、と言うことです。上記の原理から、SHGで微小管の構造相違を光で検出できるはずです。しかしながら、これまでに誰もこのコンセプトを証明できていませんでした。それは、SHG計測の感度が悪く、微小管1本から発生したSHGを検出することができなかったからです。私たちは、2年の歳月をかけて、SHG顕微鏡の高感度化に取り組み、微小管1本のSHGを検出することに成功しました(図)。この新しいSHG顕微鏡を用いて、活性化した微小管と不活性化した微小管のSHG光に確かに違いがあることが分かり、微小管に「赤と青」の状態があることの証明となりました。さらに私たちは、タンパク質結晶内における動的な構造変化をSHG計測で追跡することにも成功し、SHG
がタンパク質構造計測に有用であることを示すことができました。

- SHG計測の医療分野への応用
- 上記の研究を皮切りとして、私たちは、SHG顕微鏡を用いて筋繊維の活性化を非接触で計測する方法を確立しました。現在、その方法を基に、ヒトiPS細胞から作成した心筋細胞の品質管理技術の開発を行っています。
Mechanism of pluripotency/difference in embryonic stem cells
- 胚性幹細胞(ES細胞)が集団で分化する仕組み
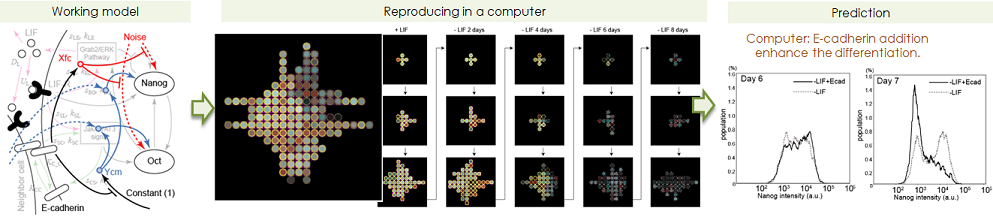
- ES細胞は、体を構成するどの細胞にも分化できる能力(多能性)を持っている細胞として良く知られています。私たちの興味は、その多能性のメカニズムではなく、ES細胞が分化する時に発揮する不思議な能力です。ES細胞は、それ単体では生きられず、沢山の細胞が集まらないと生きていけません。その集団の中のES細胞を100個を見てみると、100個の細胞には多少のばらつきはあるものの、おおむね、同じようなふるまいをします。つまり、多数の細胞がひとつの細胞塊として協同的に生きているのです。これは、私たち人間が個人個人で生きているにも関わらず、家族や会社と言う集まりを作り、その集まりを一単位として機能していることと似ています。私たちは、ここに「フラクタルな個と集合の関係性」を解き明かすためのヒントが隠されていると考えました。私たちは、多能性状態を維持するのに必須であるタンパク質(転写因子)Nanog、Oct4の発現について、未分化状態から初期分化8日目まで毎日100細胞隗ずつ(計約27,000細胞)の顕微鏡像を取得しました(図左)。この膨大な画像データから、集合(塊)における各細胞の位置、Nanog/Oct4の発現量、および、他細胞との接触の情報を収集しました(図中)。様々な解析を行った結果として、①細胞(個)の状態は激しく揺らいでいるが、細胞隗(集合)の中では細胞間の相互作用により、その揺らぎが抑制されること、②細胞間相互作用がの強弱が細胞隗の多様性の弱強となり、ひいては細胞の分化状態遷移を引き起こすこと、が明らかになりました(図左)。このメカニズムは、筋繊維の力発生、鳥の集団運動、コンサートでのスタンディングオベーション等と酷似しており、スケールを超えた生命の根本メカニズムでると考えられます。
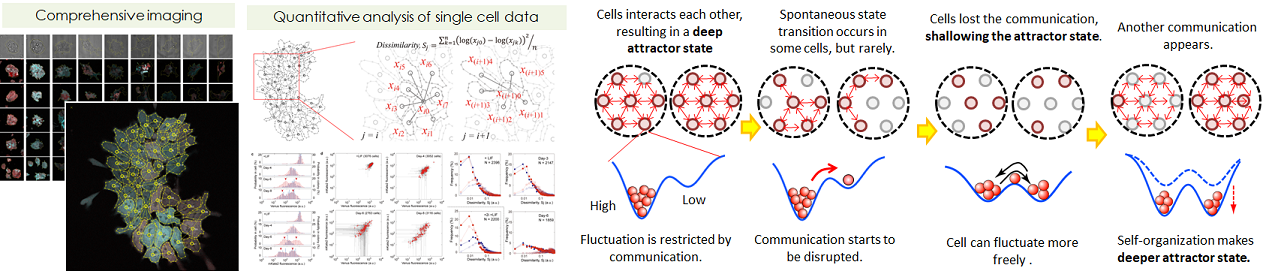

- ES細胞の集団分化をコンピュータ上で再現し、現象を予測する。
- 私たちは、上に書いた実験で得られた定量的なデータから、ES細胞の集団分化を再現できる数理モデルを構築しました(図右)。この数理モデルにより、「ES細胞が、未分化状態では隣接する細胞の発現ゆらぎを小さくする相互作用を行っており、分化が始まるとその相互作用は消滅し新たな相互作用が生まれている」と言う顕微鏡で観察した様子をコンピュータ上で可視化することができます(図中)。数理モデルですから、各種パラメータが設定されており、そのパラメータを自由に変えることで、細胞接着を阻害した時の表現型や細胞密度による影響を予想することができます。私たちの作った数理モデルによると、細胞間接着に関係するカドヘリンを培養液に加えることで、未分化のES細胞はより未分化を維持しようとし、逆に、分化を開始したES細胞は素早く分化しようとすると予測されました。実際に、培養液内に精製したカドヘリンを加えてみると、数理モデルが示した結果と同じ結果を得ることができました(図右)。もちろん、まだまだ、ほんの少しの生命現象を予測したにすぎませんが、今後、このような定量データから作った数理モデルが蓄積されていけば、細胞すべての現象を完全予測できるようになるかも知れません。

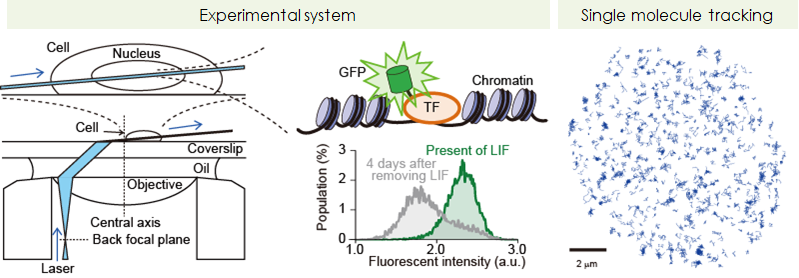
- 多能性維持を担う転写因子が働く現場を可視化する
- ES細胞の多能性維持に必須な転写因子について、その発現量および発現パターンに関する研究は数多くありますが、まさにタンパク質として機能する瞬間を観察した研究例はほとんどありません。つまり、これらの必須転写因子がES細胞内で機能する詳細なメカニズムはわかっていないのです。私たちは、細胞核内で働く転写因子の挙動を顕微鏡下でひとつ(1分子)ずつ観察する技術を確立しました(図右)。転写因子がDNA上の標的箇所に結合する様子を直に観察することができるようになり(図左)、転写因子が標的箇所まで移動する速度や、そこに滞在する結合時間など、様々な物
理パラメータを取得できます。なによりも、実際に目の前で、タンパク質が働くその瞬間を観ることができるので、私たち生命科学研究者は観察している現象について「スタティックな(静的)イメージ」ではなく「ダイナミックなイメージ」を頭に描くことができます。今後、通説を覆すような新しいコンセプトがこの研究から生まれると期待されます。