研究内容
- これまでの成果・終了したプロジェクト
- 現在進行中のプロジェクト
- 共同研究
これまでの成果・終了したプロジェクト
生体分子モーターの動作原理について
モータータンパク質は10 nmオーダーの分子であり、ナノの世界では避けられない熱雑音にさらされながら力発生や1方向性の運動を行います。力学的な仕事を行うために必要な入力エネルギーはATP(アデノシン三リン酸)を加水分解することによって得られる化学エネルギーです。この入力エネルギーの大きさは20kBT程 度なので、半導体素子などの人工機械のように莫大なエネルギー(108 kBT /bit)を注いで熱ノイズを遮断することは出来ないために、人工機械とは異なる方法で 熱ノイズに対処して細胞内での生理的機能を果たす必要があります。
生命システムの各階層(分子レベル、分子集合体レベル、細胞レベルなど)で熱ノイズや確率的な機能発現プロセスへの対処法(もしくは共存の方法、論理)があると思いますが、私は、光ピンセットを用いた単一分子の力学的操作と1分子イメージングを基本にした1分子計測技術を改良しつつ分子レベルで上記課題へのアプローチを行ってきました。
その中でも、重要な成果を以下に紹介しておきます。
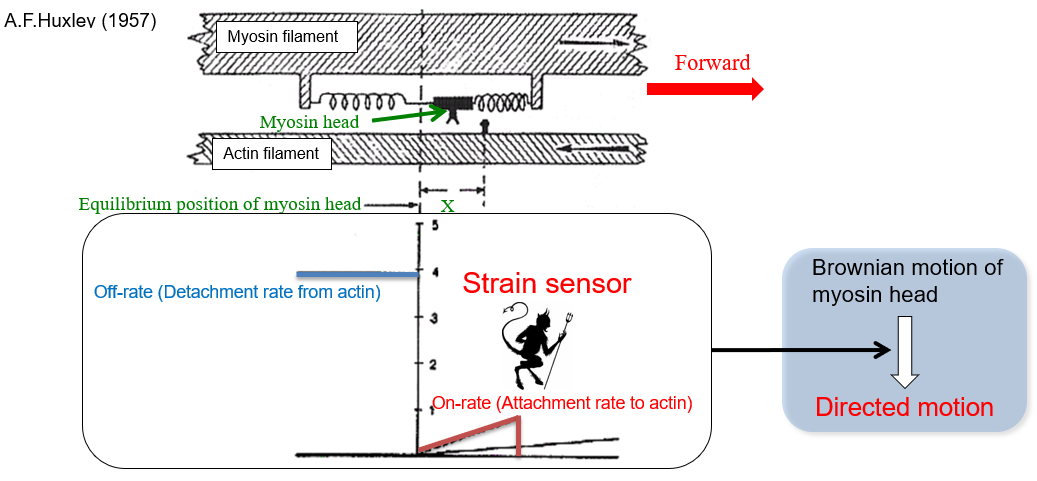
1. 機械刺激応答性とブラウン運動を利用したモーター機能発現(ストレインセンサー機構)
詳細はリンク先(日本語), (英語)に譲りますが、モーターの1方向性運動で本質的なのは、運動方向性の決定機構もしくは運動の非対称性の生成機構になります。
近年のマイクロ秒領域での1分子ナノイメージングか ら、モーター分子(ミオシンV, VI) がランダムなブラウン運動過程を経て方向性が決まる動きが直視されています。方向性を決定する実体として、モーターの機械刺激応答性に着目し実験を行ったところ、モーター分子はストレインセンサーを持つことで自身の前後方向を検知し、方向性を決めることが分かりました。ランダムな運動から方向性や仕事を取り出すという意味において、マクスウェルの悪魔を見かけ上実現しており、ストレインセンサーが悪魔の実体に対応することになります。
ただ、ATPの化学状態変化(Piの放出)とはカップルしているので熱力学の法則を破っているわけではありませんが、ミオシンV、VIと呼ばれる生体分子モーターがこのような仕掛けを持ったブラウン運動駆動型の分子機械であることを示すことが出来ました。ATPのエネルギーはブラウン運動を止めるのに使われるということになります。
参考文献
- “Brownian search-and-catch mechanism for myosin-VI steps.”
M. Iwaki, A. H. Iwane, T. Shimokawa, R. Cookes and T. Yanagida
Nature Chemical Biology 5:403-405 (2009)
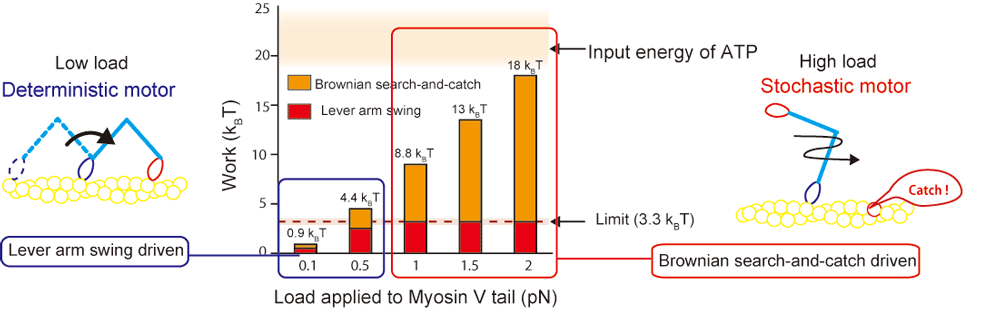
2. ブラウン運動過程の力学制御から見えてきたエネルギー変換素過程
こちらも詳細はリンク先(日本語)、(英語)に譲りますが、実は、ミオシンV, VIの1方向運動の素過程には2種類あることもマイクロ秒領域でのナノイメージングから見えていました。1つは、上で書いたストレインセンサーを使ったブラウン運動整流過程(Brownian search-and-catchと名付けました。) であり、もう一つはミオシンのレバーアームとよばれる部位の構造変化に起因する運動過程です。この運動は生物学の教科書で必ず書いてある筋収縮の分子機構モデルで、広く認知されています。近年の1分子計測技術の発展によりモデル通りにレバーアームが構造変化するのは分かりましたが、エネルギーに関する情報(実際の機能発現中での実測値)がこれまではありませんでした。つまり、
- レバーアームの構造変化で実際にどのくらいの仕事ができるのか?
- Brownian-search-and-catchで出せる仕事はどのくらいなのか?
ここがモーターの研究で本質的であり、よく分からなかったところになります。この問題では、DNA分子をナノ材料として用い1分子計測技術と組み合わせた実験系を構築することによって解くことができました。
結論だけ書くと、ミオシンVの最大力発生時には、レバーアームの構造変化は、全体の仕事の15%程度しか貢献しないという結果でした。残りはBrownian search-and-catchがまかなっていることになります。少なくともミオシンVではこのような結果となりました。レバーアームの構造安定性はミオシンの種類によっても異なる可能性もあるので、筋肉のミオシン(ミオシンII)でどうなっているのか気になるところです。
この成果で大事なのは、教科書に修正をせまるというだけでなく、Brownian search-and-catchという確率過程が大きな役割を果たし、ミオシンVの細胞内での生理的機能を考えるうえで非常に巧みな性質を持っていることが示唆できるところになります。
ミオシンVは細胞内では小胞輸送を行うデリバリー屋としての役割を持っています。鉄道のレールや高速道路のように整備された道とは異なり、ミオシンVの進むレールは、アクチンフィラメントという細胞骨格にフィラミンなどの数多くの蛋白質が結合しています。その上、細胞質は非常に混雑しているので、モーターから見ると、障害物だらけの道を進む必要があります。Brownian search-and-catchは ブラウン運動ですので、障害物を避けて拡散し、前方のアクチンフィラメントの足場から適当な位置を探索して結合することができます。そのため、細胞内のような障害物の多い環境でもロバストに輸送機能を果たせるのではないかと考えられます。
天然のナノマシンは、このように、構造変化による、ある意味必然的な仕組みと、Brownian search-and-catchによる偶然性の高い仕組みを絶妙な配分でハイブリッドさせて生体内で効率良く機能するように設計されていると言えます。
参考文献
- “Switching of myosin-V motion between the lever-arm swing and Brownian search-and-catch.”
K. Fujita*, M. Iwaki*†, A. Iwane, L. Marcucci, T. Yanagida
Nature Communications, 3, 956 (2012) (*equally contribution, †corresponding)
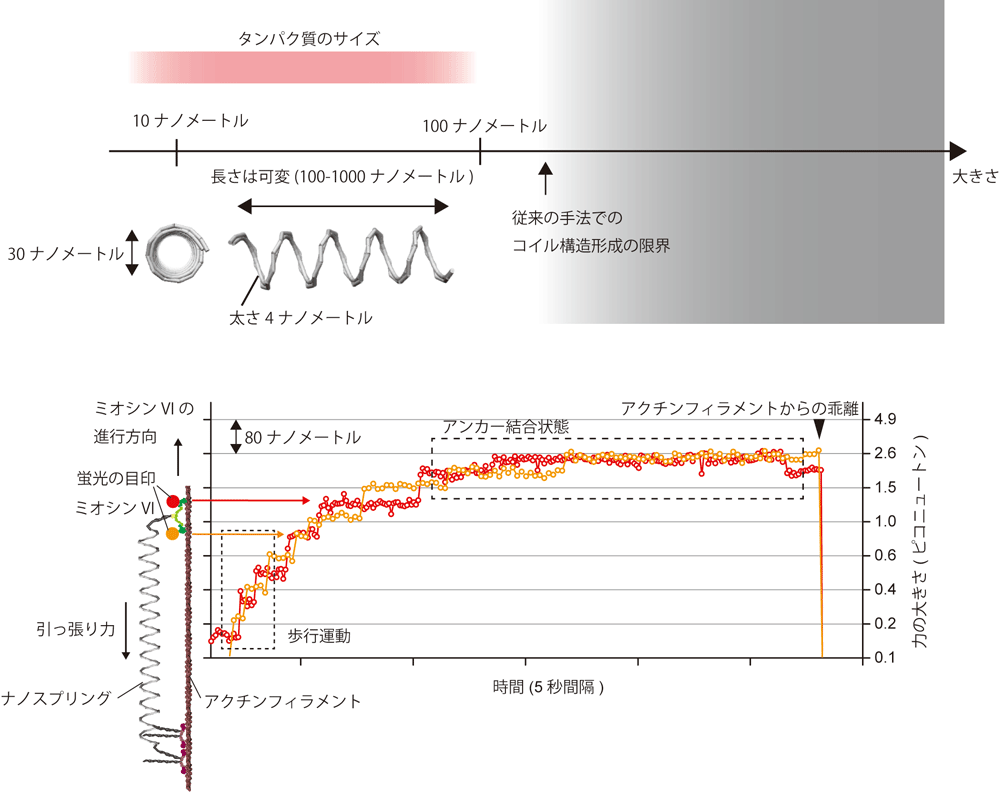
3. ミオシンVIにおける外力依存的な運動様式の切り替え
ミオシンVIは、当初、レバーアームが短いにもかかわらず大きなステップ(力発生)をするミオシンとして注目されました。いわゆるレバーアーム仮説に合わないモーターとして研究が進んできましたが、細胞内での小胞輸送と膜張力保持(アンカー機能)という生理的な多重機能の面からも注目されていました。機械的な力によって、これら2つの生理機能の切り替えが行われることが予想されましたが、実際にモーターの機能の切り替えが行われることを直視した例はありませんでした。そこで、DNAナノスプリング(現在進行中のプロジェクト参照)を用いて、機械的な力をかけた状態のミオシンVIの高精度1分子イメージングを行うことで、低負荷では、人が歩くようにハンドオーバーハンドで小胞輸送を行い、高負荷では、尺取虫のような動き(インチワーム運動)に切り替えて、レールとなるアクチンフィラメントに強固に固定するイベントを直接観察することに成功しました。ハンドオーバーハンドは、ATPのエネルギーを使って効率的に小胞輸送できる反面、外力に弱い運動様式ですが、インチワーム運動では、外力を分子内でうまく分散し、アクチンからはずれにくい構造を形成するため、アンカー機能を発揮できると考えられます。また、アンカー機能は、貝柱のキャッチ筋内に存在するミオシンが知られていますが、こちらは、アンカー機能を発揮するのに別のアクセサリタンパクを必要としATPのエネルギーを消費しないと言われています。ミオシンVIのアンカー状態では、ATPのエネルギーを消費し、アンカー時にも時々分子の重心位置を微調整している様子が観察されています。ミオシンVIは膜張力保持の中でも、聴覚器官である蝸牛内のステレオシリアの形態維持がよく知られており、音の振動に伴うダイナミックな膜張力変動が考えられます。その変化にうまく適応できるように、ATPのエネルギーを消費して強固な結合状態を微調整していることも考えられます。将来的に、多様な力学機能を持つナノマシン設計に有用な指針となると期待しています。
参考文献
- “A programmable DNA origami nanospring that reveals force-induced adjacent binding of myosin VI heads"
M. Iwaki†, S.F. Wickham, K. Ikezaki, T. Yanagida, W.M. Shih
Nature Communications, 7, 13715 (2016) (†corresponding)
現在進行中のプロジェクト
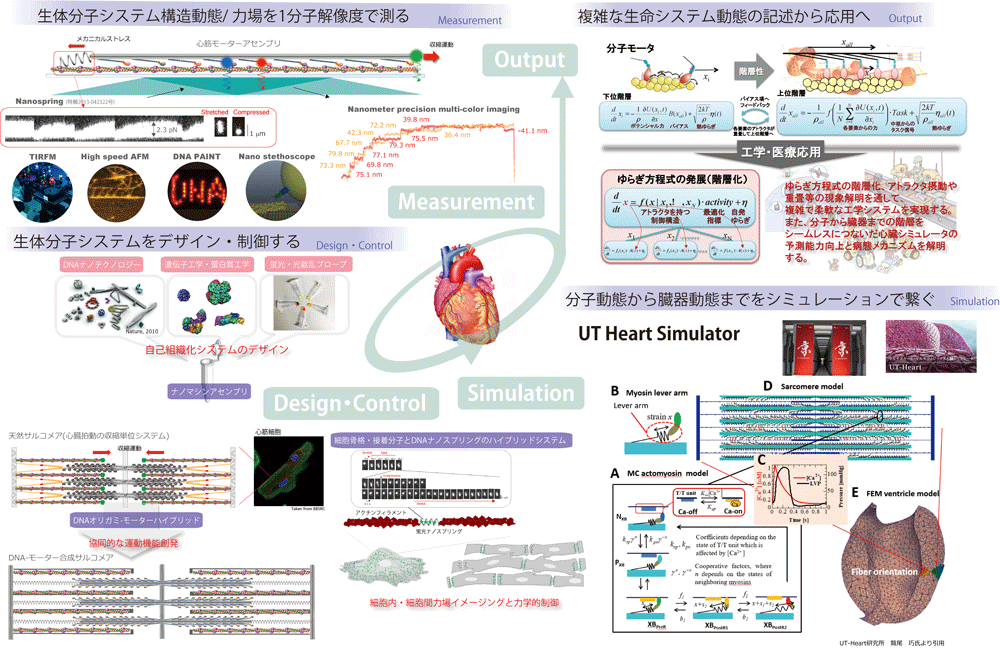
心臓・骨格筋のシステム物理生物学
これまでの分子レベルの成果を踏まえて、心臓や骨格筋を対象に、分子から臓器までの階層をシームレスにつないでシステムとして理解・制御する取り組みを行っています。基礎研究としての重要性に加え、肥大型心筋症といった遺伝的心疾患の病態メカニズム解明や精密医療への貢献を目指しています。
分子より上の階層の動態や構造を分子解像度で捉えるために、先端1分子計測技術(1分子蛍光イメージング、レーザー暗視野イメージング、光ピンセット法など)に加え、DNAナノテクノロジー(DNA origami)、超解像イメージング(DNA-PAINT)、高速原子間力顕微鏡観察および、心臓シミュレータとの連動をしながら研究を進めています。
具体的には以下のストラテジーで進めています。
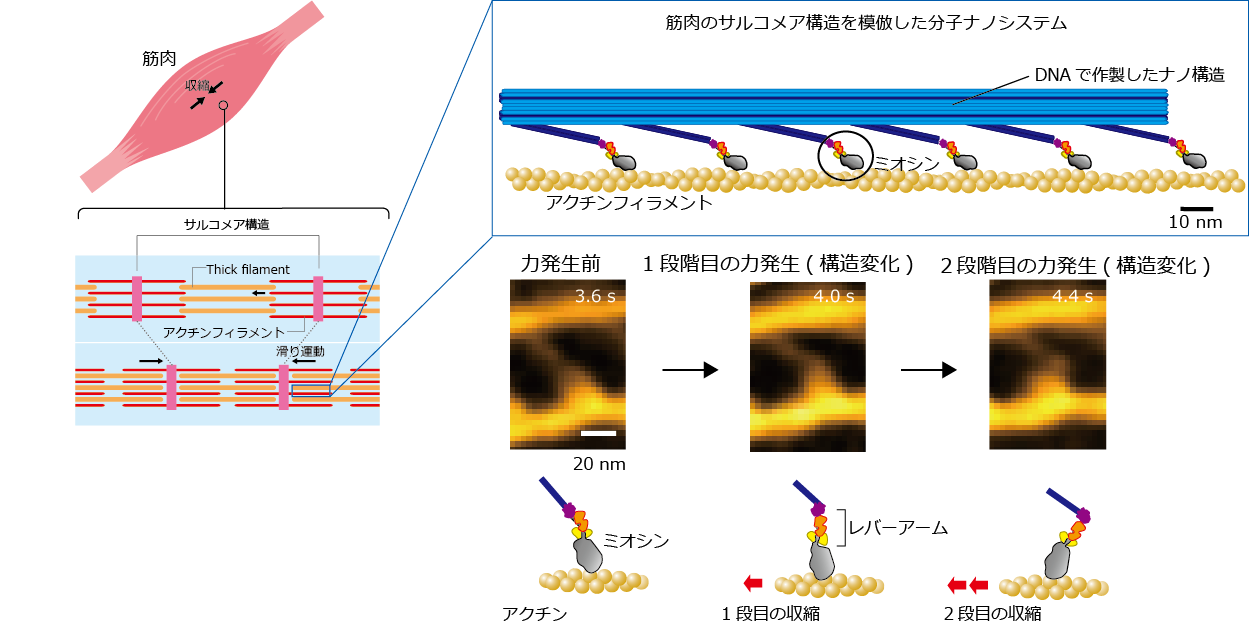
骨格筋や心筋は、進化の過程で最適化された厳密な高次構造(サブセルラーモジュール)であるサルコメアが直列・並列に配置されており、内部には分子モーターであるミオシン分子が密に並んでいます。これまでの研究により、ミオシン1分子の動作は理解されつつありますが、単離された状態での動作であり、サルコメア内での動作が1分子レベルで直視された例はありません。システム内に組み込まれた分子は、周囲の分子との力学的な相互作用やカルシウム応答により協同的に動作し、安定かつ効率的な収縮・拍動、外力場への適応、ロバストネスを獲得すると考えられます。サルコメア内の個々の分子動態をイメージングするために、本研究では、DNA origami技術を応用して、サルコメア内のミオシン分子の空間配置や分子数、分子種が厳密にコントロールされたプラットフォーム(人工ミオシンフィラメント、人工サルコメア)をデザインしています。このアプローチには以下のメリットがあります。
- 30種類以上のタンパク質からなるサルコメア構成要素の中で、発現や再構成が難しい構造タンパク質(タイチン、ネブリンなど)をDNA origami (DNAナノ構造物)で置き換えるので、容易に再構成が可能
- DNA origamiのデザイン能力が高いため、進化の過程で得られた筋肉の空間配置の役割の検証、心筋症の原因となる変異型ミオシン、心筋α,βミオシンを混在させるなど生体内で想定されるヘテロなミオシン集団の定量解析および、サルコメア内の任意の位置に蛍光・光散乱プローブを複数種ラベルできるので、分子間の協調性を定量的に解析可能、高速AFMでの解析がしやすいように分子システムを構成可能
- 複雑なサルコメアを粗視化しモデル解析と密に連動させることで、筋収縮の本質的なアーキテクチャを理解、ステップバイステップでサルコメアタンパク質を追加や複雑性を上げられるので、サルコメア内における各因子の機能が明確に解析可能
サルコメアは、分子と細胞をつなぐ階層に位置し、このプラットフォームを用いて得られるデータを心臓シミュレータにデータ同化させることで、シミュレータの予測能力の向上および、分子・サルコメア動態と臓器動態との連関が議論できるようになります。
このように、"単分子分解能での動態計測", "分子・細胞システムのデザイン", "階層をつないだシミュレーション"を連動させることによって、分子レベルから臓器レベルまでの動態をシームレスにつないだ理解を目指しています。そのために、現在はin vitro実験が主ですが、骨格筋細胞や心筋細胞を使ったin vivo実験の立ち上げや共同研究、心臓にX線をあててサルコメア動態を高解像度で計測する in situ実験との共同研究なども進めようとしています。
1. ミオシンフィラメント内のミオシン分子動態を精密に分析するための分子プラットフォーム
DNAorigamiを用いることで、天然のミオシンフィラメント構造を模倣した足場構造を作製しました。進化の過程で自然に設計されたサルコメア構造はミオシン分子間の協同運動などに影響を与え、筋収縮に最適な集団運動を生み出すと考えられています。従来の方法で再構成されたミオシンフィラメントは、天然のミオシンフィラメント構造を厳密には再現せず、さらには、高密度にミオシン分子が集積しているため、個々のミオシン分子動態を1分子解析することが難しかったのですが、DNAorigamiを足場にしたミオシンフィラメントによって解決することができました。レーザー暗視野イメージング、高速原子間力顕微鏡観察を行い、フィラメント内のヒトミオシンの動作が初めて直接的に可視化されました。今後は、肥大型心筋症を引き起こすミオシン変異体の動作や、ミオシンをターゲットにした心筋症の薬の候補となる低分子化合物の作用を精密に分析するプラットフォームとしての利用を行います。得られた結果を心臓シミュレータにデータ同化させることで心臓の各階層での影響を調べ、精密医療に繋げます。
参考文献
- “Direct visualization of human myosin II force generation using DNA origami-based thick filaments"
K. Fujita, M. Ohmachi, K. Ikezaki, T. Yanagida, M. Iwaki†
Communications Biology, in press (2019) (†corresponding)
DNAメカノテクノロジー・超解像イメージング
本研究室では、DNA origamiと呼ばれる技術を最大限に活用します。DNA origamiは、遺伝子の実体であるDNAをナノ材料として用い、様々なナノ構造物を作成する技術で、生物学、物理学、材料科学やコンピュータ科学などの広範な分野に応用されるようになりつつあります。デザインの複雑性と大規模化の能力は年々進歩しており、DNAの塩基配列情報をベースにした、分子の空間制御、自己集合制御能を活用して、センサー、演算、アクチュエータ機能等を持ったナノスケールデバイスを実現できるようになり、NatureやScienceの表紙を飾ることも増えてきました。
本研究室では心臓研究への応用を進めていますが、以下のプロジェクトも推進しています。
1. 世界最小のコイル状人工バネ(ナノスプリング)を用いた分子・細胞・組織のフォースセンシング
DNAのみを材料にして、コイル状の人工バネを作成しました。タンパク質と同程度のサイズであり、利点としては、
- バネの硬さがプログラム可能
- 化学修飾が容易で多様な生体分子に連結可能
- 線形バネに近い弾性を持つため定量性が高い(高分子ポリマーや弾性タンパク質は物性が複雑)
- 生体適合性が高い
が挙げられます。
in vitro実験における実用化を終えており、モーター分子が生み出す力学的相互作用や力学特性の評価とFIONA, SHRECといったナノメートル精度の1分子蛍光イメージングを同時にできるようになりました。現在では、心筋細胞を含む様々な細胞種の細胞内・細胞間および組織内にナノスプリングを連結し、細胞が生み出す機械的な力(=力学的シグナル)のイメージング・操作するための開発に取り組んでいます。将来的には、光応答性の分子と組み合わせることで光学的にナノスプリングを伸縮させることができるため、光制御のメカノバイオロジーが実現できると期待しています。メカノバイオロジーが対象とする様々な細胞、組織の研究、発生やオルガノイド研究などへの応用を目指しています。

参考文献
- “A programmable DNA origami nanospring that reveals force-induced adjacent binding of myosin VI heads"
M. Iwaki†, S.F. Wickham, K. Ikezaki, T. Yanagida, W.M. Shih
Nature Communications, 7, 13715 (2016) (†corresponding)
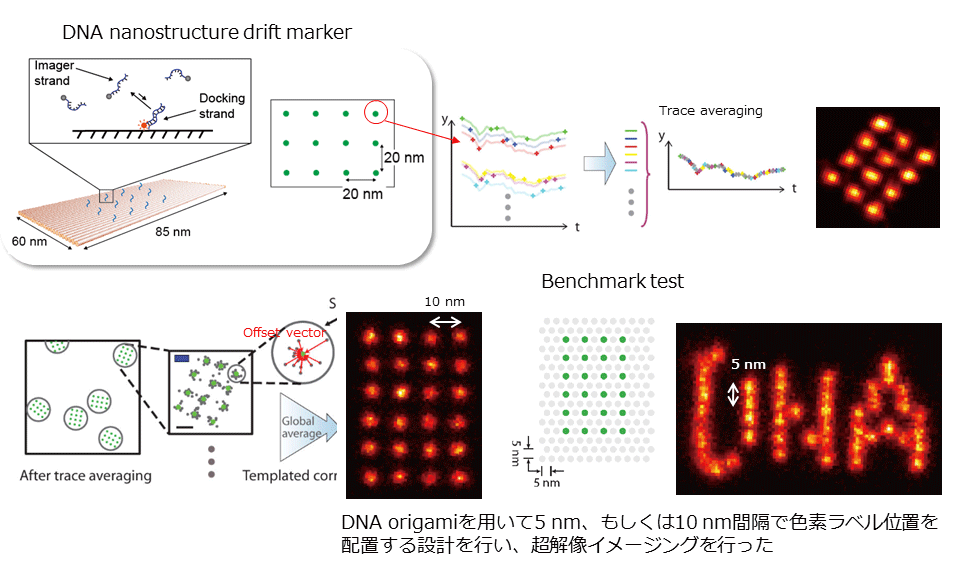
2. 究極解像度の超解像イメージング技術(DNA-PAINT)を用いた細胞内分子観察
DNA-PAINT (DNA-based Point Accumulation for Imaging in Nanoscale Topography)は、超解像イメージングの一種である蛍光分子局在化法(PALM, STORMなど)であり、PALM, STORMの空間分解能である20-30 nmをはるかにしのぐ、2-3 nmの解像度を実現します (参考文献:Dai et al., Nature Nanotech., 2016)。空間分解能を向上させるポイントは、蛍光ラベルした一本鎖DNAとその相補鎖のハイブリダイゼーションを利用した蛍光分子の明滅キネティクス制御と、顕微鏡のドリフト補正を極限まで行うためのドリフトマーカーをDNA origamiにて作成するところになります。現在、細胞膜上のEGFレセプターの会合状態や筋細胞内のサルコメア、細胞骨格構造観察などに応用を進めています。
ナノバイオロボティクス
本研究室では、生命現象を1分子解像度で観察することにこだわりを持って装置開発などを行っています。これまでのタンパク質1分子レベルでの研究によって、タンパク質構造の不均一性や多形性、記憶現象が観察されています。このことは、同一のタンパク質分子種でも分子ごとに個性を持つことを意味しており、このような個性(=自律性と可塑性)を持った要素が自己組織化されて細胞などが構築され、生命機能が創発します。そのため、無個性で均質な要素のみから構成されることの多い人工機械システムとは対照的です。無個性で均質な要素からなる集団であれば、個々の要素を見ずに集団平均でも理解ができそうですが、不均質で時々刻々と状態が変化する個性を持った分子システムでは、個々の状態の時間的な変化や状態の分布を知る、そして集団平均に隠れたレアイベント、レア状態を捉えることが重要だと考えています。レアなイベントやレア状態がシステム全体を大きく変えることがあるからです。このようにバラエティを持つ要素はある意味不安定であり、工学的な視点からは信頼できないネガティブな印象もありますが、外乱に対する適応性や柔軟性を獲得し、環境変動にも耐えうる安定なシステムを実現するための性質としてポジティブに利用しているようにも見えます。本研究室では、アクチュエータとして働く分子モーターや遺伝子転写・合成に関わるような分子モーター群から構成されるシステムをDNA origamiと組み合わせてシステムを構成し、1分子解像度で解析することで生体分子システムの機能創発を理解しようとしており、そのような再構成のアプローチをナノバイオロボティクスと名付けました。Richard Feynmanの”What I cannot create, I do not understand”というメッセージどおり、作って理解するというスタンスです。
共同研究
1. 細胞・組織の機械的な力のイメージング
細胞実験に適用可能なDNAバネを開発しており、様々なメカノバイオ研究への応用や準備を始めています。(豊島文子先生 (京大)、島本勇太先生(遺伝研)、大橋一正先生(東北大学)に提供中)
2. DNAオリガミ技術の社会実装
SIM、STEDやSTORMといった超解像顕微鏡の性能評価用のナノメートルものさしを開発しました。(岡田康志先生 (東大/理研BDR)、中野明彦先生(理研/東大)、株式会社ニコン様、平野泰弘先生(阪大)、茅元司先生(東大)に提供中、日本光電株式会社様と議論中)
3. キネシン、ダイニン分子の多体化、外力場中での1分子動態計測
多体化用のDNAロッド、ナノスプリングを用いてキネシンの輸送機構や力発生機構の研究に利用していただいています。(富重道雄先生(青学大)、須河光弘先生(東大)、岡田康志先生 (東大/理研BDR)、林久美子先生(東北大)、島本勇太先生(遺伝研)に提供中)
4. 1分子計測用プローブの時系列データからの分子運動およびポテンシャル場の推定
蛋白質にラベルした金ナノ粒子プローブの高速1分子観察データを基に、実際の分子運動およびポテンシャル場を推定する信頼性の高い手法の開発を行っております。
(深澤正彰先生(阪大)との共同研究)
5. ライン光ピンセット法を用いた溶媒和構造の研究
(天野健一先生(名城大)との共同研究)
6. 高速原子間力顕微鏡での細胞膜レセプター観察用のDNAオリガミプローブ開発
(市川壮彦先生(金沢大学福間研究室)との共同研究)





